벼 재배 논토양에서 메탄의 생성 및 배출: 리뷰
 ; Choi, Eun Jung*
; Choi, Eun Jung* ; Lee, Sun Il*
; Lee, Sun Il* ; Lee, Hyoung Seok*
; Lee, Hyoung Seok* ; Lee, Jong Mun**
; Lee, Jong Mun** ; Kang, Seong Soo***
; Kang, Seong Soo***
Abstract
In Korea, approximately 22% of domestic methane (CH4) emissions are emitted from rice cultivation. Various studies have sought to reduce CH4 emission from rice cultivation, but studies conducted in Korea have not been reviewed. In this review, we suggest directions for research by summarizing CH4 study cases of rice paddies in Korea. In addition, we provide background information on CH4 emissions. In flooded paddies, an anaerobic environment develops; when soil redox potential reaches -200 mV, methanogens are promoted. When substrates such as acetic acid and hydrogen/carbon dioxide, which are the decomposition products of organic matter, are supplied at the optimum soil temperature of 20-40℃, CH4 emissions are accelerated. After that, 80-90% of CH4 generated from the soil is released into the atmosphere through the aerenchyma of rice. Studies have explored CH4 emissions related to various agricultural activities that affect methanogen activity in Korea. A significant number of studies have focused on the management of paddy water and organic matter in relation to increases or decreases in CH4 emissions. However, most studies were short-term evaluations of CH4 emissions. In addition, detailed analysis of the factors influencing CH4 emission was lacking in investigations focusing on the amount of CH4 emissions. Therefore, including the effects of long-term soil management on CH4 emissions, studies should be conducted a detailed part of each affecting CH4 emission factor, in future research. These results could contribute to decreasing national CH4 emissions by providing specific measures for how to strategically reduce CH4 emissions in the future.
Keywords:
Korea, Rice Paddy, Methane (CH4), Methanogenesis, Methanogen, Methane Emission1. 서론
장기체류 온실가스(Long-lived greenhouse gases, LLGHGs)인 메탄(CH4)은 이산화탄소(CO2) 보다 약 15 ~ 34배 강한 온난화 효과를 지닌 기체이다(Malyan et al., 2016). 산업화 이후부터 대기 중 메탄 농도는 꾸준한 증가 추세로, 현재 농도는 1879 ppb(2020년)로 산업화 이전(722 ppb) 대비 260% 증가하였다(Butler and Montzka, 2020; WMO, 2020). 그 결과 메탄의 복사 강제력에 의한 지구온난화 영향은 전체 온실가스의 16% 정도이며, 이산화탄소(66%) 다음으로 큰 부분을 차지하고 있다(Butler and Montzka, 2020).
Saunois (2020) 등의 연구에 의하면 매년 전 세계적으로 576 Tg의 메탄이 지속적으로 배출되고 있다. 그중 전체 메탄 배출량의 약 60%(359 Tg)가 인위적 발생원에 의한 것으로 나타났다. 메탄은 이산화탄소와 달리 화석연료 연소가 주요 배출원이 아니다. 메탄 배출은 대부분은 메탄생성균의 활동에 의한 생물적 요인에 의해 발생하고 있다. 일반적으로 메탄생성균은 산소가 부족한 환경에서 유기물을 분해하여 메탄을 생성한다(Malyan et al., 2016). 벼를 재배하는 담수 논은 대표적으로 산소가 부족한 환경 중 하나로, 인위적 메탄 배출량의 약 8% (30 Tg)가 벼 논에서 발생하고 있다(Saunois et al., 2020).
전체 농경지 면적의 53%(86만 5천 ha)가 논인 우리나라의 경우 국내 총 메탄 배출량의 약 22%(6.0 Tg CO2eq.)가 벼 재배과정에서 발생한다(GIR, 2019). 전세계 인위적 메탄 배출량에서 벼 재배가 차지하는 비율을 생각하면 상당한 양으로, 국가 메탄 배출 저감에 있어서 논에서 발생하는 메탄 감축은 필수적인 부분이다. 이와 관련하여 국내에서도 다양한 연구가 수행되어 왔다(Ali et al., 2009a; Ali et al., 2009b; Cho et al., 2016; Gutierrez et al., 2013; Gwon et al., 2019; Kim et al., 2014; Lee et al., 2012; Lee et al., 2020a; RDA, 2005, 2012, 2013, 2017). 그러나 국내 연구 사례에 대한 포괄적으로 정리된 바가 없어 연구 현황 파악과 함께 필요한 연구 부분에 대한 방향 논의가 어려운 상황이다. 또한 논 토양에서의 메탄 생성(methanogenesis) 및 배출에 대해 자세히 다루고 있는 국내 연구 문헌이 부재하여 논이라는 특수한 환경과 메탄 배출에 대해 처음 접하는 이들의 이해하기가 쉽지 않다. 따라서 본 리뷰를 통해 국내 논에서의 메탄 배출 현황 및 연구 사례에 대해 파악하고, 여러 연구 사례를 바탕으로 현재 필요한 연구 분야에 대한 방향성을 제시하고자 한다. 동시에 논 토양에서 메탄생성균에 의한 메탄 생성 및 배출 과정에 대한 이해를 돕기 위해 관련 정보를 함께 제공하고자 하였다.
2. 메탄 생성 및 배출과 국내 연구 현황
국내 메탄 배출 현황은 온실가스 종합센터에서 발간한 국가 온실가스 인벤토리 보고서 자료를 기반으로 작성하였다. 논토양에서의 메탄 생성 요인, 메탄 생성 및 배출 경로 등에 대한 연구자료는 구글 문헌 검색 서비스를 활용하여 선행연구 자료를 수집, 정리하였다. 국내에서 수행한 논에서 메탄 배출 관련 자료는 농촌진흥청에서 발간된 연구보고서를 위주로 연구 사례를 수집하여 정리하였다. 농촌진흥청에서 수행하지 않은 몇몇 연구에 한하여 구글 문헌 검색 서비스를 활용, 추가로 연구 사례를 수집 및 정리하였다. 정리한 자료는 국내 메탄 발생 현황, 메탄 배출 영향 인자, 메탄생성균의 분류 및 메탄생성 과정, 메탄생성균, 메탄 배출 경로, 국내 연구 사례 순으로 제시하였다.
2.1 국내 메탄 배출 현황
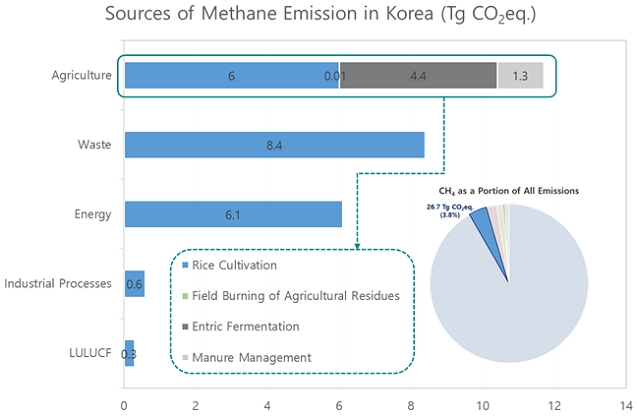
2017년 기준, 우리나라 총 메탄배출량은 26.7 Tg CO2eq.(국가 총 온실가스 배출의 3.8%)이며, 그중 농업이 가장 큰 비중을(43.9%, 11.7 Tg CO2eq.) 차지하고 있다. 농업에서 메탄 배출원은 크게 벼 재배, 작물잔사소각, 장내발효, 가축분뇨 처리로 구분된다. 벼 재배 분야는 농업부문 메탄 배출의 51.2%(6.0 Tg CO2eq.)를 차지한다는 점에서 논은 가장 중요한 메탄 배출원 중 하나이다(Fig. 1)(GIR, 2019).
2.2 벼 재배 논에서 메탄 배출 영향 인자
벼논에서 메탄 배출은 토양에서 메탄생생균의 활성과 같은 생물적 요인에 의해 조절된다. 활성에 영향을 주는 토양 환경 인자에는 토양 유기물 함량, 토양 산화환원전위, 토양 산도, 토성, 비료, 및 토양 온도 등이 있다. 토양 환경뿐만 아니라 벼 품종, 논물관리, 일교차와 계절적 변동, 등 다양한 요인 역시 메탄 배출에 영향을 주기도 한다(Malyan et al., 2016).
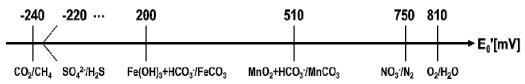
토양 산화환원 전위는 메탄 발생의 가장 중요 인자 중 하나이다. 논에 물을 가두면 강한 혐기적 환경(무산소)이 발달하면서 Eh 값은 점차 감소한다(Ali et al., 2009a). 산소가 제한된 환경에서 미생물은 산소를 대체하는 다른 전자 수용체를 사용한다. Fig. 2에 나타낸 바와 같이 산화환원전위가 높은 질산염(NO3-), 망간(Mn4+), 철(Fe3+), 황산염(SO42-), 이산화탄소(CO2) 순으로 전자 수용체가 소비된다(Hedderich and Whitman, 2006). 여러 수용체 중에서도 산화 형태의 철(Fe3+)은 전자 수용체로서 메탄생성균의 활성을 억제하여 토양에서 메탄 배출을 시킨다고 알려져 있다(Ali et al., 2012; Ali et al., 2009a; Jäckel et al., 2001). 일반적으로 토양의 산화환원전위가 -100 ~ -200 mV 정도에 이르면 메탄이 발생하기 시작한다(Dubey, 2005; Wang et al., 1993; Yagi and Minami, 1990). 혐기적 토양 환경이 극단적으로 발달하여 산화환원 전위가 -240 mV에 이르면, 철을 포함한 다른 전자 수용체들이 고갈되어 메탄생성균에 의한 메탄생성(methanogenesis)이 촉진된다(Hedderich and Whitman, 2006).
토양 유기물은 메탄생성균의 기질로 활용된다는 점에서 토양 산화환원 전위 못지않은 메탄 배출의 중요한 요인 중 하나이다. 일반적으로 벼 재배 시 가축분, 볏짚, 풋거름 등이 토양의 유기 개량제로 활용된다(Bhatia et al., 2005). 그러나 담수로 인해 혐기적 환경이 발달한 벼논에 볏짚, 풋거름, 유기질 비료 등의 유기물을 토양에 처리하면 메탄 배출이 크게 증가할 수 있다(Gwon et al., 2019; Lee et al., 2020a; Yagi and Minami, 1990). Sass (1990) 등은 식물체 생체량과 메탄 배출량 간에 유의적인 선형 관계가 있다고 하였다. 그러나 유기물임에도 불구하고 우분 퇴비와 같이 분해에 안정적인 형태의 유기물원을 투입할 경우 오히려 메탄 발생이 촉진되지 않고, 오히려 감소하기도 한다(Agnihotri et al., 1999). 특히 일반적인 유기물원(볏짚, 풋거름, 축분 퇴비 등)과 비교하여 바이오차의 경우 상대적으로 분해가 느린 탄소원으로, 최근 몇몇 연구에서 메탄 배출을 오히려 줄이는 것으로 밝혀졌다(Pandey et al., 2014; Zhang et al., 2010). 그러나 과량의 바이오차 사용 시 메탄 배출이 증가한 사례가(Zhang et al., 2012) 있는 만큼 논에서 메탄생성균의 기질로 활용 가능한 유기물의 사용에는 주의가 필요하다.
토양 온도는 메탄생성균의 활성과 유기물의 분해와 관련하여 메탄 발생에 영향을 미치는 인자이다(Peng et al., 2008). 메탄 발생의 최적 온도는 20 ~ 40℃로 알려져 있으며, 세계 여러 지역의 기후 및 토양 환경의 영향에 따라 차이를 보인다(Dubey, 2005; Hattori et al., 2001; Malyan et al., 2016; Neue and Scharpenseel, 1984; Yagi et al., 1997; Yang et al., 2015). 선행 연구에 따르면 메탄 배출은 4℃부터 증가하여 37℃에 최고치에 이르나(Yang and Chang, 1998), 10 ~ 15℃ 미만에서 극적으로 감소하고 60℃ 이상에서는 정지한다고 하였다(Pacey and Gier, 1986). 우리나라는 벼를 재배하는 6월부터 9월까지 논 토양 온도는 20℃ ~ 30℃ 범위로 메탄 발생에 적합하다. 다만 계절적 변화에 의해 9월 중반 이후로는 토양 온도가 20℃ 이하로 내려가면서 메탄 배출이 줄어들 수 있다(Chun et al., 2016). 이와 관련하여 온도와 메탄 배출 간에 양의 상관성이 확인되기도 하였다(RDA, 2012). 온도는 메탄생성균의 활성 외에도, 균이 주로 이용하는 기질에도 영향을 준다. 저온(20℃)에서는 아세트산 이용 메탄생성균이, 고온(45℃)에서는 수소/이산화탄소 이용 메탄생성균이 메탄 발생에 핵심적 역할을 한다(Chen et al., 2015).
메탄생성균은 토양 pH에 매우 민감하다(Dunfield et al., 2003; Wang et al., 1993). 대부분의 메탄생성균은 호중성(neutrophilic, pH 6.5 ~ 7.5) 또는 약염기 조건 토양에서 활성이 좋다. 반면, 토양 pH가 8.8 이상 또는 5.8 이하일 때 거의 대부분의 메탄생성균 활성이 억제된다(IPCC, 2006; Wang et al., 1993). 농업환경 변동조사에 따르면 우리나라 논 토양은 약산성으로, 메탄생성균의 활성이 억제될 수 있다고 판단할 수 있다. 그러나 벼논처럼 담수 토양의 pH는 초기 토양에 상관없이 보통 7.0을 나타내어 메탄 배출에 적합한 환경이 조성되기 때문에 실제로 토양 pH가 메탄 배출에 영향을 주기는 어려울 것으로 보인다(Wassmann et al., 1998).
토성은 토양의 물리화학적 성질을 결정하는 요소로, 메탄 발생에 간접적인 영향을 미친다(Le Mer and Roger, 2001). Jackel (2001) 등은 토양 입단의 크기가 증가할 때 메탄 발생이 증가한다고 하였으며, Sass (1994) 등은 메탄 배출과 점토(clay) 함량 간에 음의 상관관계가 있음을 밝혔다. 그러나 토성과 메탄 배출의 관계는 절대적이지 않다. 토성의 영향을 일부 받는 토양의 투수성이 메탄 배출에 더 큰 영향을 주기 때문이다. Yagi (1998) 등은 투수성과 메탄 배출량 간에 음의 관계가 있음을 밝혔으며, 이와 관련하여 투수성 개선(0 mm d-1 → 4 mm d-1) 으로 58% 가량의 메탄을 감축한 사례가 있다(Inubushi, 1992). 우리나라에서도 양토(점토함량 30 ~ 50%)와 미사질식양토(점토함량 50 ~ 70%)에서 각각 벼를 재배하고 메탄 배출량을 비교한 연구가 있다. 연구결과 점토함량이 더 높은 미사질식양토에서 메탄 배출량이 35 ~ 59% 높게 나타나, 토성이 메탄 배출에 절대적인 기준이 아님을 확인하였다(Choi et al., 2019).
벼논에서 메탄 배출은 벼 생육 단계의 영향을 받는다. 담수 기간이 짧은 벼 이앙 후 식물의 활착기(뿌리내림기) 단계에서는 메탄생성균의 낮은 활성으로 인해 메탄 배출이 적다(Conrad, 2007). 그러나 벼의 성장과 함께 메탄 생성에 이용되기 쉬운 토양 유기물 분해 산물의 형성, 담수 논 토양의 혐기 환경의 발달로 인해 메탄 배출은 증가한다(Li et al., 2011). 일반적으로 벼의 분얼기(새끼치는 기간)에 가장 높은 메탄 배출이 관측된다(Alberto et al., 2014; Bhattacharyya et al., 2014; Miyata et al., 2000; Suryavanshi et al., 2013). 이는 근권의 풍부한 뿌리 삼출물, 미생물의 유기물 분해 등에 의해 기질이 풍부한 영향으로 알려져 있다(Holzapfel-Pschorn and Seiler, 1986; Kimura et al., 2004; Mitra et al., 1999; Suryavanshi et al., 2013; Tokida et al., 2010). 이와 마찬가지로 메탄생성균이 이용하기 쉬운 기질원의 가용도에 따라 출수기(이삭팰 때, 이앙 후 70일경)부터 초기 등숙기(여뭄기) 사이(Inubushi et al., 2003; Singh et al., 1998), 또는 개화기(이앙 후 80일경) (Meijide et al., 2011)에 가장 높은 메탄 배출이 관측되기도 한다. 반면, 일반적으로 벼 출수 이후에는 광합성량 감소, 종실 증대로 인해 메탄생성에 필요한 동화산물의 가용도 감소로 메탄 배출도 감소하는 경향이 나타난다(Sinha, 1995).
메탄 배출은 벼 품종 특성에 따라 달라지기도 한다(Adhya et al., 1994; Aulakh et al., 2000; Gutierrez et al., 2013; Kumar and Viyol, 2009; Mitra et al., 1999). 선행연구에서는 조생종(52 ~ 112 kg CH4 ha-1)에서 적은 메탄이, 만생종(116 ~ 142 kg CH4 ha-1)에서 많은 메탄이 배출되었다. 또한 다수확 벼품종이 적은 생산량을 가진 벼품종보다 메탄 배출이 많았다(Setyanto et al., 2000). 이러한 메탄 배출량 차이는 작물 재배기간 차이뿐만 아니라, 벼 품종별로 식물체에서 생성되는 뿌리 삼출물(exudate)의 양, 볏짚 및 뿌리 조직의 분해, 뿌리에 있는 메탄생성균의 군집 수준 등이 다르기 때문으로 알려져 있다(Wang et al., 1997). 뿐만 아니라 품종별 메탄 운송 능력 차이에 따라 메탄 배출은 영향을 받을 수 있다(Aulakh et al., 2000).
논에서 배출되는 메탄은 벼 재배에 사용하는 비료의 종류, 양, 시용 방법 등에 영향을 받는다(Banger et al., 2012; Datta et al., 2013; Jain et al., 2004; Lindau, 1994; Linquist et al., 2012; Yang et al., 2015; Yang et al., 2014). 질소는 대표적인 비료 성분으로, 질소원에 따라 메탄 배출도 영향을 받는다. 선행 연구에 따르면, 요소(urea) 비료는 메탄생성 과정에 유리하도록 토양 산화환원전위(Eh value) 감소, 토양 pH 증가 효과가 있는 것으로 확인되었다(Wang et al., 1993). 반면, 질산암모늄(ammonium nitrate)을 사용할 경우에는 메탄 배출이 감소한다(Lindau, 1994). 이는 질산이 전자 수용의 경쟁적 저해제로 작용하여 메탄 배출을 줄이기 때문이다. 마찬가지의 원리로 황산염을 포함하는 유안(ammonium sulfate)과 황산칼슘(calcium sulfate)을 토양에 시용한 경우에도 메탄 배출이 감소한다(Cai et al., 1997).
소수의 연구에서 메탄 발생에 농약이 미치는 영향에 대해 밝힌 바 있다. 일반적으로 사용하는 제초제(butachlor 성분), 살진균제(tridemorph 성분), 살충제(carbofuran 성분)는 메탄 발생을 저해한다. 제초제인 부타클로르(butachlor)를 처리한 결과 58%(Jiang et al., 2015), 98%(Mohanty et al., 2004) 가량 메탄 배출이 감소하였으며, 이는 토양 산화환원 전위 증가와 메탄생성균의 군집 감소에 의한 것으로 나타났다. 반면, 처리 수준에 따라 살진균제인 트리데모르프(tridemorph)는 50 ~ 100 μg kg-1 수준으로 토양에 처리 시 메탄생성을 억제하나, 토양에 5 ~ 20 μg kg-1 처리 시에는 오히려 메탄 발생이 증가하기도 한다(Bharati et al., 1999). 살충제 성분인 카보퓨란(carbofuran)도 마찬가지로, 토양에 카보퓨란을 저농도로 처리하면(5, 10 μg g-1) 메탄 산화가 강화, 메탄 배출이 감소하나(Sethunathan et al., 2000), 고농도(100 μg g-1) 처리 시에는 오히려 메탄 산화가 저해되어 메탄 배출이 증가할 수 있음이 확인되었다(Kumaraswamy et al., 1998).
2.3 메탄생성균에 의한 메탄 생성
논에서 배출되는 메탄은 토양 속 메탄생성균이 만드는 것으로, 앞서 말한 여러 인자가 메탄생성균의 활성에 영향을 미친다. 주요 메탄생성균(methanogens)은 분류학적으로 고세균(Archaea)역, 고세균(Archaebacteria)계, 에우리고세균(Euryarchaeota)문에 속하며, 그 이하는 3강, 6목, 12과, 35종으로 분류된다(Fazli et al., 2013; Malyan et al., 2016). 일반적으로 메탄생성균은 절대적인 혐기(무산소) 환경에서 활동한다(Conrad, 2007). 모든 메탄생성균의 독특한 특징은 포름산(formate), 에탄올(ethanol), 아세트산(acetate), 수소(H2) 및 이산화탄소(CO2) 등 단순한 기질을 이용하여 메탄을 생성하여 에너지를 얻는다는 점이다(Conrad, 2007).
메탄생성균은 주로 사용하는 기질의 종류에 따라 메탄생성 경로를 달리한다. 크게 세가지로 A) 아세트산 경로(aceticlastic pathway), B) 수소/이산화탄소(H2/CO2) 경로(hydrogenotrophic pathway), C) 메탄올자화 경로(methylotrophic pathway)로 구분할 수 있다(Table 1, Fig. 3).
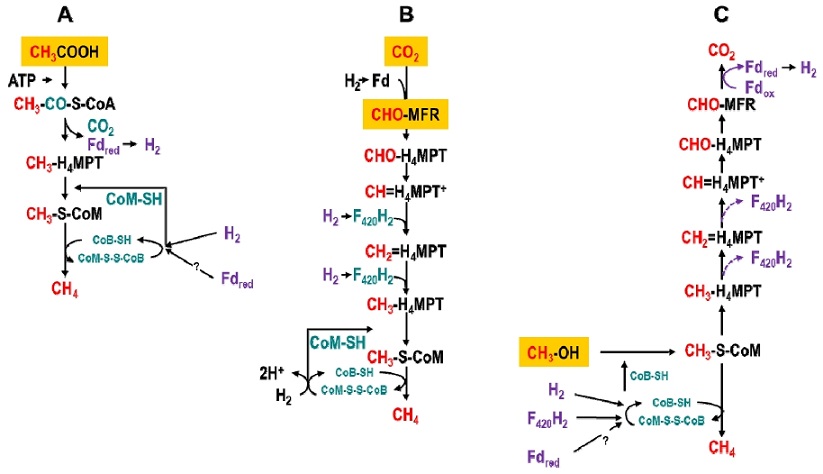
Scheme of methanogenesis from (A) Hydrogenotrophic pathway, aceticlastic pathway (B) and methylotrophic pathway (C) (Modified Hedderich and Whitman, 2006)
A) 경로에서는 기질로 아세트산(acetic acid, CH3COOH)이 활용, 메탄이 생성된다. 선행 연구에 따르면 아세트산을 주요 기질로 이용하는 메탄생성균이 전체 메탄 발생의 80% 정도를 차지한다고 알려져 있다(Chin and Conrad, 1995). 이 경로에서 아세트산의 메틸 탄소(C-2)는 카르복실 탄소(C-1)의 산화로부터 얻은 전자를 활용하여 메탄으로 환원되며, 아세트산이 메탄과 이산화탄소로 쪼개지기 때문에 이 반응을 아세트산 반응(aceticlastic reaction)이라고 부른다. 아세트산을 이용하는 메탄생성 과정은 아세트산이 인산화에 의해 아세틸-CoA (Acetyl-Coenzyme A, CH3-CO-S-CoA)로 활성화 되면서 시작한다. 활성화된 아세틸-CoA는 이후 메틸기, 카르보닐기(carbonyl group, -C(=O)-), CoA를 생성하며, 이들은 모두 효소에 일시적으로 결합한다. 이후 탈수소효소 복합체에 의해 카르보닐기가 산화되어 이산화탄소(CO2)를 형성, CoA가 효소 복합체로부터 방출된다. 이때 메틸기는 코리노이드-Fe-S(corrinoid-Fe-S) 단백질로 전이된다. 효소복합체에 의해 메틸기는 테트라하이드로메타노프테린(tetrahydromethanopterin, H4MPT)로 전이되며 이후 반응은 수소/이산화탄소(H2/CO2) 경로와 유사한 과정을 거쳐 메탄이 발생한다(Dubey, 2005; Hedderich and Whitman, 2006)
B) 경로에서는 수소와 이산화탄소가 주요 기질로 활용된다. 아세트산 다음으로 약 10 ~ 30% 정도의 메탄이 이 과정을 활용하는 메탄생성균에 의해 발생하고 있다고 알려져 있다(Palmer and Reeve, 1993). 이 경로에서 이산화탄소의 메탄으로 환원은 운반체에 결합하는 탄소를 매개로 진행된다. 주요 세 가지 운반체는 다음과 같다. 메타노퓨란(methanofuran, MFR), 테트라하이드로메타노프테린(tetrahydromethanopterin, H4MPT), 2-메르캅토에탄설포네이트(2-mercaptoethanesulfonate, coenzyme M, CoM-SH). 이때 사용되는 조효소들은(coenzyme) 메탄생성균에서 특이적으로 사용된다고 알려져 있으나, 일부 비메탄생성균 또는 고세균에서도 확인되고 있다. 메탄생성은 이산화탄소와 MFR이 전자 2개를 받아 환원되는 것으로 시작한다. 환원된 형태의 포르밀기(formyl-group, -CHO)는 조효소(coenzyme)의 아미노기(amino-group, -NH2)에 결합, 포르밀-MFR (CHO-MFR)로 전환된다. 다음으로 포르밀기는 H4MPT의 N5로 전이되며, 포르밀-H4MPT (CHO-H4MPT)는 두 단계에 걸쳐 메틸-H4MPT (methyl-H4MPT, CH3-H4MPT)로 환원된다. 이 과정에서 수소(H2)와 환원된 coenzyme F420 (F420H2)은 전자 공여체로 작용한다. 마지막으로 메틸기(methyl-group, -CH3)는 coenzyme M의 티올기(thiol-group, -SH)로 전이된다. 이때, 형성된 메틸-티오에테르(methyl-thioether)가 마지막 단계에서 환원되면서 메탄이 발생한다(Hedderich and Whitman, 2006).
C) 경로는 산소(O), 질소(N), 황(S)에 결합된 메틸기를 포함하는 단일탄소(C1) 화합물을 기질로 하는 메탄 생성 과정이다. 일반적으로 논 토양 보다는 사해 또는 석탄층과 같은 특이적인 환경에서 서식하는 메탄생성균에 의해 메탄이 생성되는 경로이다(Doerfert et al., 2009; Oremland et al., 1982). 사용되는 기질의 종류에는 메탄올(methanol), 모노메틸아민(monomethylamine), 디메틸아민(dimethylamine), 트리메틸아민(trimethylamine), 테트라메틸암모늄(tetramethylammonium), 디메틸설파이드(dimethylsulfide), 메티올(methiol) 등이 있다. 메틸기(-CH3)는 coenzyme M 경로를 통해 메탄으로 환원된다. 이 반응에서 필요한 전자는 이산화탄소의 메탄 환원 경로 역반응 과정을 이용한 추가적인 메틸기의 산화를 통해 얻어진다. 산화과정에서 6개의 전자를 얻을 수 있다. 2개의 전자가 메틸기의 메탄 환원에 필요하기 때문에 이 반응의 화학량론에 따르면 이산화탄소(CO2) 1분자 당 메탄 3분자가 만들어진다(Hedderich and Whitman, 2006).
이상, 대표적인 세 가지로 구분된 메탄생성 경로는 메탄생성균에 따라 각각 다를 수 있으나 methyl-coenzyme M (CH3-S-CoM)과 coenzyme B (CoB-SH)의 이황화합물(heterodisulfide, CoM-S-S-CoB) 형성은 메탄생성 과정에서 나타나는 공통적인 주요 반응이다. 이 반응을 촉매하는 methyl-coenzyme M reductase (MCR)은 메탄생성의 주요 효소로서 메탄생성균에서 특이적으로 존재한다(Hedderich and Whitman, 2006).
2.4 논 토양에서 대기로의 메탄 배출 경로
벼 재배 논에서 메탄은 기체 상태 또는 물에 녹은 상태로 존재한다(Tokida et al., 2010). 지하부의 총 메탄 중 33 ~ 88%는 가스 상태로 토양 내에 존재하며(Green, 2013; Strack and Waddington, 2008; Tokida et al., 2005), 토양에 갇힌 메탄은 일반적으로 1) 식물체를 통한 운송(transport), 2) 분출(Ebullition), 3) 확산(Diffusion) 경로를 통해 대기로 배출된다(Fig. 4).
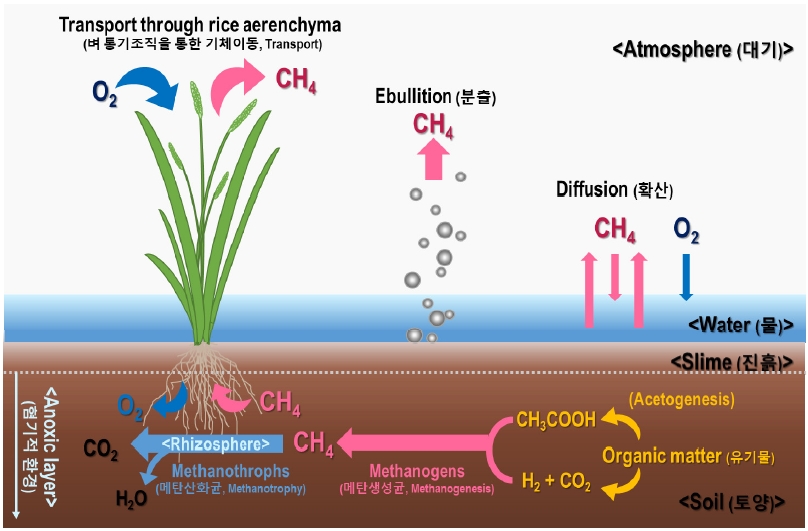
Conceptual schematic diagram of methane production, oxidation and emission from paddy field (Modified Dubey, 2005; Rajkishore et al., 2015)
식물체를 통한 운송(transport)경로는 식물의 통기조직(aerenchyma)을 통해 대기중으로 메탄이 배출되는 것을 말한다(Cicerone et al., 1983; Das and Baruah, 2008; Nouchi et al., 1990; Sass et al., 1990; Seiler et al., 1983; Watanabe et al., 1994). 통기조직은 담수 환경에서 식물이 적응하기 위해 기포를 갖는 변형된 실질조직으로 벼 뿌리 호흡을 위한 산소전달이 주요 기능이다(Armstrong, 1978; Jensen et al., 1967). 메탄은 통기조직을 통해 근권부에서 대기로 운송되며(de Bont et al., 1978), 논에서 배출되는 메탄의 80 ~ 90% 정도가 이 경로를 따른다(Holzapfel-Pschorn and Seiler, 1986; IPCC, 2006; Schütz et al., 1989; Setyanto et al., 2004). 이때, 메탄은 1차적으로 낮은 잎 위치의 엽초(잎집, leaf sheath)에 있는 미세공으로부터 배출되며, 2차로는 엽신(잎몸, leaf blade)에 있는 기공(stomata)으로부터 배출된다(Nouchi et al., 1990). Das와 Baruah (2008), Chanton (1997) 등이 기공 밀도와 메탄 배출 속도 간에 상관을 관찰하고, 증산과 메탄 배출이 연관이 되어 있음을 밝힌 바 있다.
분출(Ebullition)은 혐기적 토양에 식물이 없거나 식물체의 통기조직이 잘 발달되지 않았을 때 메탄의 주요 배출 경로이다(Byrnes et al., 1995). 일반적으로 자연적 습지에서 메탄이 대기중으로 배출되는 경로이며(Wassmann and Martius, 1997), 다량의 유기질 비료 처리 시 메탄 운송에 크게 관여하는 경로이기도 하다(Sass et al., 1994). 분출은 오직 토양 표면층에서만 발생하며, 메탄의 농도, 온도, 토양 공극, 식물체 통기조직 발달 등에 따라 분출 속도가 달라진다(Li, 2000).
확산(Diffusion)은 지표수 내 메탄 농도 차이에 의해 토양에서 대기로 메탄이 이동하는 것을 말한다(Sebacher et al., 1983). 토양을 통한 메탄의 확산은 기체 메탄의 확산속도가 액상에서 매우 낮기 때문에 토양 용액 중에서는 몹시 느린 과정으로(기상을 통한 확산보다 약 104배 느림), 총 메탄 배출에는 거의 영향을 주지 못한다(Aulakh et al., 2000).
2.5 논에서의 메탄 배출 관련 국내 연구 현황 및 사례
앞서 말한 대로 국내 메탄 배출의 약 22% 이상이 벼 재배 과정에서 발생한다는 점에서 논은 주요 메탄 저감 관리 대상이다. 그러나 논에서 메탄 배출을 연구하기 위해서는 일정 규모의 벼 재배 시험 포장뿐만 아니라 벼를 포함할 수 있는 일정 크기 이상의 온실가스 포집 챔버 및 메탄 분석 장비가 기본적으로 요구되기 때문에(Gwon et al., 2019) 연구 진입 장벽이 다소 높다. 이러한 영향으로 논에서의 메탄 배출에 대한 국내 연구 초기에는 대부분이 농촌진흥청을 중심으로 수행되어 왔으며, 이후 점차 확산되었다. 국내에서는 메탄 배출에 가장 큰 영향을 미치는 토양 산화환원 상태, 유기물 함량과 관련하여 논물 및 유기물 관리에 대한 연구들이 가장 다양하게 수행되어 왔으며, 농촌진흥청을 중심으로 실시된 국내 연구 사례는 Table 2에 나타낸 바와 같다.
논 토양은 담수에 의해 산소공급을 제한 받아 혐기적 환경이 발달하며, 그 결과 메탄이 배출된다(Hedderich and Whitman, 2006). 이러한 원리를 역으로 활용하여 논 토양을 호기적으로 관리하면 메탄을 줄일 수 있어 국내외로 논물관리에 대한 메탄 배출 영향이 다양하게 연구되어 왔다. 국내 논물관리 연구 사례는 벼 재배 전과 벼 재배 중으로 크게 구분할 수 있다. 먼저, 벼 재배 전 논물관리에 대한 연구로, 벼 재배 전 담수 기간에 따라 작기 중 메탄 배출도 달라짐이 확인되었다. 모내기 전 비담수 기간을 180일 미만 유지를 기준으로 메탄 배출을 비교하였을 때, 180일 이상 비담수 유지 조건에서는 메탄 배출이 약 16% 감소한 반면, 모내기 전 30일 이상 물을 가두어 논을 관리하였을 때는 메탄 배출이 약 12% 증가하였다(RDA, 2012). 동일한 원리로 건답 논에 볍씨를 직파하는 경우에도 호기적 토양 환경을 유지하기 때문에 관행적 이앙법과 비교하여 메탄 배출을 31 ~ 40% 줄일 수 있었다(RDA, 2005).
다음으로, 벼 재배 중 논물관리에 대한 국내 연구 사례가 있다. 벼 재배 중 상시담수 조건에서 벼를 재배하지만 낮은 논물 수위 유지 및 암거배수 시설 설치를 통해 토양 내 산소 확산을 용이하게 하여 메탄 배출이 줄어드는 것을 확인하였다(RDA, 2005). 그러나 상시담수 조건보다 벼를 재배하는 도중에 일시적으로 논물을 배수하는 중간물떼기 및 걸러대기(water saving drainage)를 실시하였을 때 큰 메탄 배출 저감 효과가 확인되었다(상시담수 대비 66 ~ 72% 저감)(RDA, 2012, 2013, 2017). 실제로 벼 재배 중 중간물떼기 기술은 활용이 쉬운 만큼 대다수의 농가에서 실시하는 농법으로, 연구분야에서도 다른 메탄 감축 기술과 함께 복합적으로 적용하는 연구가 수행되기도 하였다(RDA, 2020). 그러나 벼를 재배하는 농업 환경이 중간물떼기를 수행하기 부적합한 농가도 있어 획일적인 논물관리는 불가하다. 따라서 각각의 농가에 적용할 수 있도록 논물관리 방법이 개발 및 개선될 필요가 있다.
앞서 토양 유기물은 메탄생성균의 기질로 활용되며, 유기물 시용 수준과 메탄 배출 간에는 선형 관계가 있다고 하였다. 국내에서 수행한 연구에서도 볏짚 1 Mg ha-1 당 메탄 배출이 61 ~ 62 kg 증가하였으며(RDA, 2005, 2012), 자운영의 경우 1 Mg ha-1 당 메탄 배출이 46kg 증가하는 경향을 확인하였다(RDA, 2005). 논에 유기물을 처리하면 메탄 배출이 증가하는 부작용이 있으나, 토양의 지속성을 유지하기 위해서 토양 유기물 환원은 필요하다. 이와 관련하여 메탄 배출 부작용을 최소화하는 유기물 시용 방법으로, 볏짚 및 풋거름 작물을 벼 재배 전 이른 시기에 토양에 환원하는 방법에 대해 연구한 사례가 있다. 비담수 상태의 호기적 환경의 토양에 유기물을 환원하면 상대적으로 미생물이 이용하기 쉬운 탄소원이 이산화탄소 형태로 분해, 유기물이 안정화된다. 그 결과 벼 재배 시기인 담수 상태의 혐기적 토양 환경에서 메탄생성균이 이용하는 기질이 제한되어 메탄 배출이 감소하는 것이 확인되었다(Lee et al., 2020b; RDA, 2019). 마찬가지로, 퇴비화 과정을 통해 안정화된 형태의 돈분 및 계분 톱밥퇴비를 시용할 경우 30%의 질소비료 대체 효과와 함께 볏짚 처리구 대비 메탄 배출을 5 ~ 9% 저감할 수 있다. 다만 우분톱밥퇴비를 시용하였을 경우, 탄소 함량은(43.1%) 높으나 질소 함량(0.79%)이 낮아, 질소비료 30%를 대체하기 위해 과량의 퇴비 투입이 요구되어 오히려 메탄 배출이 볏짚 대비 7% 증가하였다(RDA, 2005). 이처럼 토양에 시용할 수 있는 유기물원의 종류, 시용 수준 및 방법을 다양하게 적용할 수 있는 만큼 메탄 배출을 최소화하는 방안에 대해 지속적인 연구가 필요할 것으로 판단된다.
경운은 토양을 갈아엎어 섞어주는 영농법으로 토양을 느슨하게 하고, 잡초를 제거하는 등의 이점이 있다. 국내에서 연구된 사례 중 경운과 관련하여 토양에 유기물을 환원하고 깊이 갈아엎어 벼를 재배 할 경우, 얕게 경운한 것과 비교하여 모내기 이후 초반 메탄 배출이 억제되어 총 메탄 배출이 감소할 수 있는 것이 확인되었다(Cho et al., 2016). 그러나 지속적인 경운은 토양 입단 파괴, 기계적 다짐에 의한 경운판 형성 등의 영향으로 토양의 물리성을 악화시킬 수 있다. 일반적으로 작물 잔사 등이 토양 표면에 분포하는 무경운과 달리 경운을 실시하면 작물 잔사가 토양에 유입되어 담수환경에서 분해되면서 토양 용존 산소를 대량 소비, 혐기적 토양 환경이 발달함에 따라 메탄 배출이 증가할 수 있다. 반면, 무경운 조건에서는 입단이 잘 보전됨에 따라 토양 공극이 발달, 기체 확산이 영향을 받으면서(Gregorich et al., 2006) 메탄 산화가 용이한 환경이 조성되어 메탄 배출이 감소할 수 있다(Regina et al., 2007). 국내에서 수행된 연구에서도 경운 대비, 무경운 벼 재배 논에서 메탄 배출이 22 ~ 51% 감소하는 것으로 나타났다(RDA, 2005). 그러나 예상 외의 결과로, 5년 이상 무경운을 실시한 논에서 토양 유기물 함량이 증가함에 따라 오히려 메탄 배출이 증가한 국내 사례가 있다(Kim et al., 2016). 따라서 장기간 무경운을 실시한 논에서 토양 유기물과 관련한 메탄 배출 변화에 대한 추가적인 연구가 필요할 것으로 판단된다.
비료 사용은 농업의 생산량 유지 및 증대를 위해 필수적인 부분이다. 앞서, 요소 비료는 메탄 배출이 용이한 토양 환경을 조성한다고 하였다(Wang et al., 1993). 국내에서 실시한 연구에서도 요소 시용 수준이 증가할수록 총 메탄 배출도 증가하는 것이 밝혀졌다. 그러나 일정수준 이상 비료를 시용할 경우 식물체의 메탄 산화 잠재력이 증가하여 오히려 메탄 배출이 감소할 수 있음이 확인되기도 하였다(Kim et al., 2016).
토양 개량제는 양분 공급이 주 목적인 비료와 달리, 토양의 물리·화학·생물성 등을 개선하기 위해 토양에 시용하는 물질을 일컫는다. 일반적으로 산성 토양의 pH를 높이는 토양 개량제로 석회가 사용되는데, 논에 시용할 경우 메탄 배출이 약 20% 증가하는 것으로 나타났다(RDA, 2005). 반면, 토양의 물리성을 개선하는 인공 제올라이트를 시용한 경우 메탄 배출이 23% 정도 감소하는 것으로 나타났다(RDA, 2005). 벼에 필요한 규산 공급을 목적으로 사용하는 규산질 비료의 경우 메탄 배출을 15 ~ 36% 가량 줄였다(Ali et al., 2009b; Lee et al., 2012; RDA, 2005). 이는 규산질 비료에 포함된 철이 경쟁적 전자 수용체로 작용하여 메탄생성과정을 저해한 것으로, 규산질 비료 외에도 철을 포함하는 다른 물질 처리에서도 동일한 효과를 볼 수 있었다(Gwon et al., 2018).
벼 재배기간이 단축되어 논물을 가두는 기간이 짧은 만큼 조생종 벼는 중만생종 벼보다 총 메탄 배출이 적을 수 있다(RDA, 2012). 그러나 앞서 말한 바와 같이 벼는 토양 내 메탄생성균은 벼 뿌리를 통해 유기산을 공급받는다. 또한 벼 기공의 발달 정도에 따라 메탄 수송 능력 등이 영향받을 수 있기 때문에, 각각의 벼 품종이 지닌 특성에 따라 메탄 배출도 차이를 보일 수 있다. 국내에서는 다양한 벼 품종 별 메탄 배출량이 조사된 바 있으며, 벼 품종에 따라 메탄 배출이 차이가 있는 것이 확인되었다(RDA, 2005, 2012). 국내 벼 품종을 대상으로 한 Abtulba 등(2015)의 연구에 따르면 각각의 품종이 지닌 벼 뿌리를 통한 토양으로의 산소 전달력에 따라 메탄 산화력이 영향을 받으면서 메탄 배출이 차이가 난다고 하였다. 그러나 어떠한 특성이 벼 품종 간 산소 전달력의 차이의 원인인지 등에 대한 세부적인 조사가 이루어지지 않아 추가적인 연구가 필요하다고 판단된다.
메탄 배출 저해제는 일반적으로 메탄생성균에 의한 메탄 생성의 마지막 단계에 관여하는 MCR의 활성을 억제한다. 이와 관련하여 국내에서 수행한 연구들에서도 메탄생성균 저해제를 처리하였을 때 메탄 배출량이 조사되었으며, 연구 특성 상 처리 수준별 반응 비교가 쉽도록 실내 포트 실험으로 진행되었다. 실험결과 EDTA (ethylenediamine tetraacetic acid)를 처리할 경우, 무처리 대비, 18 ~ 23%의 메탄 배출이 감소하였다(Pramanik and Kim, 2017). 그러나 EDTA는 메탄생성균 외에도 다른 토양 미생물의 활성을 함께 억제하여 실제 활용에는 어려운 것으로 나타났다. 반면, 메탄생성균에 특이적 저해제인 BES(2-bromo ethane sulfonate)를 처리할 경우 무처리 대비 최고 49% 메탄 배출이 감소하는 것으로 나타났다. 그러나 고가의 BES를 벼 재배 농가에 적용하는 것은 비용 문제로 인해 어렵다. 이를 보완하는 최근 연구 사례로, 메탄생성 저해와 관련된 에틸렌(ethylene)의 전구체 에테폰(ethephon)은 무처리 대비, 43% 가량 메탄 배출을 줄일 수 있으면서 상대적으로 가격도 저렴하여 활용 가능성이 높은 것으로 판단된다. 그러나 대부분의 실험이 실내에서 제한된 조건에서 수행되었기 때문에 실제 벼 포장에서도 동일한 결과가 나오는 가에 대해 후속 연구가 필요한 것으로 보인다.
앞서 토양의 특성(토성, pH, 온도 등)이 메탄 배출에 미치는 영향에 대해 설명하였다. 우리나라에서도 토성 및 토양의 염농도에 의한 메탄 배출 영향이 조사된 바 있다. 토성과 관련하여, 벼 재배 논 토양의 점토 함량이 증가할수록 메탄 배출이 감소하는 경향이 확인되었다(Cho et al., 2016). 그러나 반대로, 토성이 메탄 배출에 큰 영향을 미치지 않은 것으로 판단되는 연구결과도 있어(Choi et al., 2019), 이전 설명에서 밝힌 바와 같이 메탄 배출이 토성보다는 투수성 등 토양의 다른 요인의 영향이 더 큰 것으로 판단된다. 토양 염 농도와 관련하여서는 간척지 토양을 활용한 포트실험으로 메탄 배출 영향이 국내에서 조사된 바 있다(Lim et al., 2013). 염 농도와 메탄 배출량 간에는 부의 상관관계가 확인되었으며, 이는 메탄생성균의 활성을 감소시키는 토양 환경 때문으로 생각된다. 간척 농지의 상당부분이 벼 재배에 특화되어 있다는 점에서(Jae-gwon et al., 2020) 일반 논 토양과 다른 간척지 논에서의 실제 메탄 배출에 대한 비교 연구가 필요할 것으로 생각된다.
3. 요약
우리나라에서 배출되는 메탄의 22%는 벼를 재배하는 논에서 발생하고 있다. 이와 관련하여 국내에서도 논에서 배출되는 메탄에 대하여 다양한 연구를 수행해 왔다. 그러나 연구 사례에 대해 전반적으로 정리된 바가 없어 연구 현황 및 필요한 연구 부분에 대한 파악이 어렵다. 본 리뷰에서는 국내에서 실시한 논에서의 메탄 관련 연구 사례에 대한 정리를 통해 앞으로 필요한 연구 부분에 대한 방향성을 제시하고자 하였다. 동시에 논이라는 특이적 환경에서 메탄 배출에 대한 이해를 돕기 위해 관련 배경 지식에 대한 정보도 함께 제공하고자 하였다. 물을 가둔 논은 혐기적 환경이 발달하여 산화환원전위가 음의 값을 나타내며, -100 ~ -200 mV에 이르면 메탄생성균의 활성이 촉진되어 메탄이 배출된다. 또한 균의 최적 조건인 토양 온도 20 ~ 40℃에서 유기물의 분해산물인 아세트산과 수소/이산화탄소와 같은 기질이 공급되면 메탄 배출이 더욱 가속화된다. 이후, 토양 내에서 발생한 메탄의 80 ~ 90%는 식물체 기공을 통해, 그 외 일부는 분출 및 확산 과정을 통해 대기 중으로 방출된다. 그동안 국내에서는 메탄생성균의 활성에 영향을 주는 여러 영농활동 별 메탄 배출에 관한 연구가 이루어져 왔다. 상당수의 연구들이 메탄 배출 증감과 관련하여 논물 및 유기물 관리에 초점을 두고 수행되었다. 그 외에도 토양 관리, 식물체(벼 품종), 메탄 배출 저해제 영향 등에 대한 메탄 배출량이 조사된 바 있다. 그러나 대부분의 연구들은 단기적인 메탄 배출량 평가 위주로 수행된 것들로 장기적인 영농활동에 의한 메탄 배출 영향에 대한 조사는 다소 미흡했다. 또한 메탄 발생량에 한정된 결과 중심으로 조사되어 메탄 배출에 영향을 미치는 인자에 대한 세부적인 분석이 다소 부족하기도 했다. 따라서 앞으로의 연구는 장기적인 토양 관리 등에 의해 변화하는 메탄 배출을 포함하여 메탄 배출에 영향을 미치는 각각의 요인에 대한 세부적 연구가 필요할 것으로 판단된다. 이로부터 얻는 연구 결과를 활용하여 차후 전략적으로 메탄 배출을 줄이는 방법에 대한 구체적 방안 제시를 통해 국가 메탄 배출 저감에 기여할 수 있을 것이다.
Acknowledgments
본 연구는 농촌진흥청 국립농업과학원 농업과학기술 연구 개발사업(PJ01558001) 지원에 의해 이루어진 것임.
References
-
Adhya TK, Rath AK, Gupta PK, Rao VR, Das SN, Parida KM, Parashar DC, Sethunathan N. 1994. Methane emission from flooded rice fields under irrigated conditions. Biology and Fertility of Soils, 18(3), 245-248.
[https://doi.org/10.1007/BF00647675]

-
Agnihotri S, Kulshreshtha K, Singh SN. 1999. Mitigation Strategy to Contain Methane Emission from Rice-Fields. Environmental Monitoring and Assessment, 58(1), 95-104.
[https://doi.org/10.1023/A:1006081317688]

-
Alberto MCR, Wassmann R, Buresh RJ, Quilty JR, Correa TQ, Sandro JM, Centeno CAR. 2014. Measuring methane flux from irrigated rice fields by eddy covariance method using open-path gas analyzer. Field Crops Research, 160, 12-21.
[https://doi.org/10.1016/j.fcr.2014.02.008]

-
Ali MA, Farouque MG, Haque M, ul Kabir A. 2012. Influence of Soil Amendments on Mitigating Methane Emissions and Sustaining Rice Productivity in Paddy Soil Ecosystems of Bangladesh. Journal of Environmental Science and Natural Resources, 5(1), 179-185.
[https://doi.org/10.3329/jesnr.v5i1.11574]

-
Ali MA, Lee CH, Kim SY, Kim PJ. 2009a. Effect of industrial by-products containing electron acceptors on mitigating methane emission during rice cultivation. Waste Management, 29(10), 2759-2764.
[https://doi.org/10.1016/j.wasman.2009.05.018]

-
Ali MA, Lee CH, Lee YB, Kim PJ. 2009b. Silicate fertilization in no-tillage rice farming for mitigation of methane emission and increasing rice productivity. Agriculture, Ecosystems & Environment, 132(1), 16-22.
[https://doi.org/10.1016/j.agee.2009.02.014]

- Armstrong W. 1978. Root aeration in the wetland condition.‘Plant life in anaerobic environments.’ (Eds DD Hook, RMM Crawford) pp. 269–297. Ann Arbor Science Publishers Inc.: Ann Arbor, MI.
-
Atulba SL, Gutierrez J, Kim GW, Kim SY, Khan MI, Lee YB, Kim PJ. 2015. Evaluation of rice root oxidizing potential using digital image analysis. Journal of the Korean Society for Applied Biological Chemistry, 58(3), 463-471.
[https://doi.org/10.1007/s13765-015-0042-x]

-
Aulakh MS, Bodenbender J, Wassmann R, Rennenberg H. 2000. Methane Transport Capacity of Rice Plants. II. Variations Among Different Rice Cultivars and Relationship with Morphological Characteristics. Nutrient Cycling in Agroecosystems, 58(1), 367-375.
[https://doi.org/10.1023/A:1009839929441]

-
Banger K, Tian H, Lu C. 2012. Do nitrogen fertilizers stimulate or inhibit methane emissions from rice fields? Global Change Biology, 18(10), 3259-3267.
[https://doi.org/10.1111/j.1365-2486.2012.02762.x]

-
Bharati K, Mohanty SR, Adhya TK, Banerjee A, Rao VR, Sethunathan N. 1999. Influence of a commercial formulation of tridemorph on methane production and oxidation in a tropical rice soil. Chemosphere, 39(6), 933-943.
[https://doi.org/10.1016/S0045-6535(99)00025-9]

-
Bhatia A, Pathak H, Jain N, Singh PK,Singh AK. 2005. Global warming potential of manure amended soils under rice–wheat system in the Indo-Gangetic plains. Atmospheric Environment, 39(37), 6976-6984.
[https://doi.org/10.1016/j.atmosenv.2005.07.052]

-
Bhattacharyya P, Neogi S, Roy KS, Dash PK, Nayak AK,Mohapatra T. 2014. Tropical low land rice ecosystem is a net carbon sink. Agriculture, Ecosystems & Environment, 189, 127-135.
[https://doi.org/10.1016/j.agee.2014.03.013]

- Butler JH, Montzka SA. 2020. The NOAA annual greenhouse gas index (AGGI) https://gml.noaa.gov/aggi/aggi.html
-
Byrnes BH, Austin ER, Tays BK. 1995. Methane emissions from flooded rice soils and plants under controlled conditions. Soil Biology and Biochemistry, 27(3), 331-339.
[https://doi.org/10.1016/0038-0717(94)00187-6]

-
Cai Z, Xing G, Yan X, Xu H, Tsuruta H, Yagi K, Minami K. 1997. Methane and nitrous oxide emissions from rice paddy fields as affected by nitrogen fertilisers and water management. Plant and Soil, 196(1), 7-14.
[https://doi.org/10.1023/A:1004263405020]

-
Chanton JP, Whiting GJ, Blair NE, Lindau CW, Bollich PK. 1997. Methane emission from rice: Stable isotopes, diurnal variations, and CO2 exchange. Global Biogeochemical Cycles, 11(1), 15-27.
[https://doi.org/10.1029/96GB03761]

-
Chen H, Wu N, Wang Y, Peng C. 2015. Methane is an important greenhouse gas, methane emissions from unique wetlands in China: Case studies, meta anlyses and modelling. In. Higher education press and walter de Gruyter GmbH
[https://doi.org/10.1515/9783110341041]

-
Chin K-J, Conrad R. 1995. Intermediary metabolism in methanogenic paddy soil and the influence of temperature. FEMS Microbiology Ecology, 18(2), 85-102.
[https://doi.org/10.1111/j.1574-6941.1995.tb00166.x]

-
Cho H-S, Seo M-C, Kim J-H, Sang W-g, Shin P, Lee GH. 2016. Effect of Soil Texture and Tillage Method on Rice Yield and Methane Emission during Rice Cultivation in Paddy Soil. Korean J. Soil. Sci. Fert., 49(5), 564-571.
[https://doi.org/10.7745/KJSSF.2016.49.5.564]

-
Cho SR, Verma PP, Das S, Kim GW, Lim JY, Kim PJ. 2022. A new approach to suppress methane emissions from rice cropping systems using ethephon. Science of The Total Environment, 804, 150159.
[https://doi.org/10.1016/j.scitotenv.2021.150159]

- Choi EJ, Jeong HC, Kim GY, Lee SI, Gwon HS, Lee JS, Oh TK. 2019. Assessment of methane emission with application of rice straw in a paddy field. Korean Journal of Agricultural Science, 46(4), 857-868.
-
Chun JA, Shim KM, Min SH, Wang Q. 2016. Methane mitigation for flooded rice paddy systems in South Korea using a process-based model. Paddy and Water Environment, 14(1), 123-129.
[https://doi.org/10.1007/s10333-015-0484-0]

-
Cicerone RJ, Shetter JD, Delwiche CC. 1983. Seasonal variation of methane flux from a California rice paddy. Journal of Geophysical Research: Oceans, 88 (C15), 11022-11024.
[https://doi.org/10.1029/JC088iC15p11022]

-
Conrad R. 2007. Microbial Ecology of Methanogens and Methanotrophs. In Advances in Agronomy (Vol. 96, pp. 1-63). Academic Press
[https://doi.org/10.1016/S0065-2113(07)96005-8]

-
Das K, Baruah KK. 2008. Methane emission associated with anatomical and morphophysiological characteristics of rice (Oryza sativa) plant. Physiologia Plantarum, 134(2), 303-312.
[https://doi.org/10.1111/j.1399-3054.2008.01137.x]

-
Datta A, Santra SC, Adhya TK. 2013. Effect of inorganic fertilizers (N, P, K) on methane emission from tropical rice field of India. Atmospheric Environment, 66, 123-130.
[https://doi.org/10.1016/j.atmosenv.2012.09.001]

- de Bont JAM, Lee KK, Bouldin DF. 1978. Bacterial Oxidation of Methane in a Rice Paddy. Ecological Bulletins(26), 91-96.
-
Doerfert SN, Reichlen M, Iyer P, Wang M, Ferry JG. 2009. Methanolobus zinderi sp. nov., a methylotrophic methanogen isolated from a deep subsurface coal seam. International journal of systematic and evolutionary microbiology, 59(5), 1064-1069.
[https://doi.org/10.1099/ijs.0.003772-0]

- Dubey S. 2005. Microbial ecology of methane emission in rice agroecosystem: a review. Applied ecology and environmental research, 3(2), 1-27.
-
Dunfield PF, Khmelenina VN, Suzina NE, Trotsenko YA, Dedysh SN. 2003. Methylocella silvestris sp. nov., a novel methanotroph isolated from an acidic forest cambisol. International Journal of Systematic and Evolutionary Microbiology, 53(5), 1231-1239.
[https://doi.org/10.1099/ijs.0.02481-0]

- Fazli P, Man HC, Shah UKM, Idris A. 2013. Characteristics of methanogens and methanotrophs in rice fields: a review. Asia-Pacific Journal of Molecular Biology and Biotechnology, 21(1), 3-17.
- GIR (Greenhouse Gas Inventory and Research Center). 2019. National greenhouse gas inventory report of Korea. Greenhouse Gas Inventory and Research Center of Korea.
-
Green SM. 2013. Ebullition of methane from rice paddies: the importance of furthering understanding. Plant and Soil, 370(1), 31-34.
[https://doi.org/10.1007/s11104-013-1790-1]

-
Gregorich EG, Rochette P, Hopkins DW, McKim UF, St-Georges P. 2006. Tillage-induced environmental conditions in soil and substrate limitation determine biogenic gas production. Soil Biology and Biochemistry, 38(9), 2614-2628.
[https://doi.org/10.1016/j.soilbio.2006.03.017]

-
Gutierrez J, Kim SY, Kim PJ. 2013. Effect of rice cultivar on CH4 emissions and productivity in Korean paddy soil. Field Crops Research, 146, 16-24.
[https://doi.org/10.1016/j.fcr.2013.03.003]

-
Gwon HS, Khan MI, Alam MA, Das SB, Kim PJ. 2018. Environmental risk assessment of steel-making slags and the potential use of LD slag in mitigating methane emissions and the grain arsenic level in rice (Oryza sativa L.). Journal of hazardous materials, 353, 236-243.
[https://doi.org/10.1016/j.jhazmat.2018.04.023]

-
Gwon HS, Khan MI, Yoon YE, Lee YB, Kim PJ, Hwang HY. 2019. Unexpected higher decomposition of soil organic matter during cold fallow season in temperate rice paddy. Soil and Tillage Research, 192, 250-257.
[https://doi.org/10.1016/j.still.2018.11.009]

-
Hattori C, Ueki A, Seto T, Ueki K. 2001. Seasonal Variations in Temperature Dependence of Methane Production in Paddy Soil. Microbes and Environments, 16(4), 227-233.
[https://doi.org/10.1264/jsme2.2001.227]

-
Hedderich R, Whitman WB. 2006. Physiology and biochemistry of the methane-producing Archaea. The prokaryotes, 2, 1050-1079.
[https://doi.org/10.1007/0-387-30742-7_34]

-
Holzapfel-Pschorn A, Seiler W. 1986. Methane emission during a cultivation period from an Italian rice paddy. Journal of Geophysical Research: Atmospheres, 91(D11), 11803-11814.
[https://doi.org/10.1029/JD091iD11p11803]

- Inubushi K. 1992. Influence of percolation on methane emission from paddy soil. Jpn. J. Soil Sci. Plant Nutr., 63, 184-189.
-
Inubushi K, Cheng W, Aonuma S, Hoque MM, Kobayashi K, Miura S, Kim HY, Okada M. 2003. Effects of free-air CO2 enrichment (FACE) on CH4 emission from a rice paddy field. Global Change Biology, 9(10), 1458-1464.
[https://doi.org/10.1046/j.1365-2486.2003.00665.x]

- IPCC (Intergovernmental Panel On Climate Change). 2006. Guidelines for national greenhouse gas inventories. CD ou no site: www.ipcc.ch, . Guia de Boas Práticas.
-
Jae-gwon S, Chan-hee J, Dong-ho L, Seung-hwan G, Jae-do S, Gi-sung L, Jong-hwa P. 2020. The Status, Problems, and the Direction of Development of Land Use in Reclaimed Land - Survey for Local Governments and the KRC Branch in Chungnam, Jeonbuk, and Jeonnam Province -. Journal of Korean Society of Rural Planning, 26(3), 67-77.
[https://doi.org/10.7851/Ksrp.2020.26.3.067]

-
Jäckel U, Schnell S, Conrad R. 2001. Effect of moisture, texture and aggregate size of paddy soil on production and consumption of CH4. Soil Biology and Biochemistry, 33(7), 965-971.
[https://doi.org/10.1016/S0038-0717(00)00248-0]

- Jain N, Pathak H, Mitra S, Bhatia A. 2004. Emission of methane from rice fields-A review. Journal of Scientific and Industrial Research, 63, 101-115.
-
Jensen CR, Stolzy LH, Letey J. 1967. Tracer studies of oxygen diffusion throguh roots of barley, corn, and rice. Soil Science, 103(1).
[https://doi.org/10.1097/00010694-196701000-00005]

-
Jiang J, Chen L, Sun Q, Sang M,Huang Y. 2015. Application of herbicides is likely to reduce greenhouse gas (N2O and CH4) emissions from rice–wheat cropping systems. Atmospheric Environment, 107, 62-69.
[https://doi.org/10.1016/j.atmosenv.2015.02.029]

-
Kim GW, Gwon HS, Jeong ST, Hwang HY, Kim PJ. 2016. Different responses of nitrogen fertilization on methane emission in rice plant included and excluded soils during cropping season. Agriculture, Ecosystems & Environment, 230, 162-168.
[https://doi.org/10.1016/j.agee.2016.06.005]

-
Kim SY, Gutierrez J, Kim PJ. 2016. Unexpected stimulation of CH4 emissions under continuous no-tillage system in mono-rice paddy soils during cultivation. Geoderma, 267, 34-40.
[https://doi.org/10.1016/j.geoderma.2015.12.021]

-
Kim SY, Pramanik P, Gutierrez J, Hwang HY, Kim PJ. 2014. Comparison of methane emission characteristics in air-dried and composted cattle manure amended paddy soil during rice cultivation. Agriculture, Ecosystems & Environment, 197, 60-67.
[https://doi.org/10.1016/j.agee.2014.07.013]

-
Kimura M, Murase J, Lu Y. 2004. Carbon cycling in rice field ecosystems in the context of input, decomposition and translocation of organic materials and the fates of their end products (CO2 and CH4). Soil Biology and Biochemistry, 36(9), 1399-1416.
[https://doi.org/10.1016/j.soilbio.2004.03.006]

-
Kumar JN, Viyol SV. 2009. Short-term diurnal and temporal measurement of methane emission in relation to organic carbon, phosphate and sulphate content of two rice fields of central Gujarat, India. Paddy and Water Environment, 7(1), 11-16.
[https://doi.org/10.1007/s10333-008-0147-5]

-
Kumaraswamy S, Rath AK, Satpathy SN, Ramakrishnan B, Adhya TK, Sethunathan N. 1998. Influence of the insecticide carbofuran on the production and oxidation of methane in a flooded rice soil. Biology and Fertility of Soils, 26(4), 362-366.
[https://doi.org/10.1007/s003740050389]

-
Le Mer J, Roger P. 2001. Production, oxidation, emission and consumption of methane by soils: A review. European Journal of Soil Biology, 37(1), 25-50.
[https://doi.org/10.1016/S1164-5563(01)01067-6]

-
Lee CH, Kim SY, Villamil MB, Pramanik P, Hong CO, Kim PJ. 2012. Different response of silicate fertilizer having electron acceptors on methane emission in rice paddy soil under green manuring [Article]. Biology and Fertility of Soils, 48(4), 435-442.
[https://doi.org/10.1007/s00374-011-0637-2]

-
Lee JH, Lee JG, Jeong ST, Gwon HS, Kim PJ, Kim GW. 2020a. Straw recycling in rice paddy: Trade-off between greenhouse gas emission and soil carbon stock increase. Soil and Tillage Research, 199, 104598.
[https://doi.org/10.1016/j.still.2020.104598]

-
Lee JH, Park MH, Song HJ, Kim PJ. 2020b. Unexpected high reduction of methane emission via short-term aerobic pre-digestion of green manured soils before flooding in rice paddy. Science of The Total Environment, 711, 134641.
[https://doi.org/10.1016/j.scitotenv.2019.134641]

-
Li CS. 2000. Modeling Trace Gas Emissions from Agricultural Ecosystems. Nutrient Cycling in Agroecosystems, 58(1), 259-276.
[https://doi.org/10.1023/A:1009859006242]

-
Li D, Liu M, Cheng Y, Wang D, Qin J, Jiao J, Li H,Hu F. 2011. Methane emissions from double-rice cropping system under conventional and no tillage in southeast China. Soil and Tillage Research, 113(2), 77-81.
[https://doi.org/10.1016/j.still.2011.02.006]

-
Liesack W, Schnell S, Revsbech NP. 2000. Microbiology of flooded rice paddies. FEMS Microbiology Reviews, 24(5), 625-645.
[https://doi.org/10.1111/j.1574-6976.2000.tb00563.x]

-
Lim CH, Kim SY, Jeong ST, Kim GY, Kim PJ. 2013. Effect of Salt Concentration on Methane Emission in a Coastal Reclaimed Paddy Soil Condition: Pot Test. Korean Journal of Environmental Agriculture, 32, 252-259.
[https://doi.org/10.5338/KJEA.2013.32.4.252]

-
Lindau CW. 1994. Methane emissions from Louisiana rice fields amended with nitrogen fertilizers. Soil Biology and Biochemistry, 26(3), 353-359.
[https://doi.org/10.1016/0038-0717(94)90284-4]

-
Linquist BA, Adviento-Borbe MA, Pittelkow CM, van Kessel C,van Groenigen KJ. 2012. Fertilizer management practices and greenhouse gas emissions from rice systems: A quantitative review and analysis. Field Crops Research, 135, 10-21.
[https://doi.org/10.1016/j.fcr.2012.06.007]

-
Malyan SK, Bhatia A, Kumar A, Gupta DK, Singh R, Kumar SS, Tomer R, Kumar O, Jain N. 2016. Methane production, oxidation and mitigation: A mechanistic understanding and comprehensive evaluation of influencing factors. Science of The Total Environment, 572, 874-896.
[https://doi.org/10.1016/j.scitotenv.2016.07.182]

-
Meijide A, Manca G, Goded I, Magliulo V, di Tommasi P, Seufert G, Cescatti A. 2011. Seasonal trends and environmental controls of methane emissions in a rice paddy field in Northern Italy. Biogeosciences, 8(12), 3809-3821.
[https://doi.org/10.5194/bg-8-3809-2011]

-
Mitra S, Jain MC, Kumar S, Bandyopadhyay SK, Kalra N. 1999. Effect of rice cultivars on methane emission. Agriculture, Ecosystems & Environment, 73(3), 177-183.
[https://doi.org/10.1016/S0167-8809(99)00015-8]

-
Miyata A, Leuning R, Denmead OT, Kim J, Harazono Y. 2000. Carbon dioxide and methane fluxes from an intermittently flooded paddy field. Agricultural and Forest Meteorology, 102(4), 287-303.
[https://doi.org/10.1016/S0168-1923(00)00092-7]

-
Mohanty SR, Nayak DR, Babu YJ, Adhya TK. 2004. Butachlor inhibits production and oxidation of methane in tropical rice soils under flooded condition. Microbiological Research, 159(3), 193-201.
[https://doi.org/10.1016/j.micres.2004.03.004]

- Neue H-U, Scharpenseel H-W. 1984. Gaseous products of the decomposition of organic matter in submerged soils. Organic matter and rice, 311-328.
-
Nouchi I, Mariko S, Aoki K. 1990. Mechanism of Methane Transport from the Rhizosphere to the Atmosphere through Rice Plants 1. Plant Physiology, 94(1), 59-66.
[https://doi.org/10.1104/pp.94.1.59]

-
Oremland RS, Marsh L, DesMarais DJ. 1982. Methanogenesis in Big Soda Lake, Nevada: an alkaline, moderately hypersaline desert lake. Applied and Environmental Microbiology, 43(2), 462-468.
[https://doi.org/10.1128/aem.43.2.462-468.1982]

- Pacey J, Gier J. 1986. The factors influencing landfill gas production. Energy from landfill gas. Proceeding of a conference jointly sponsored by the United Kingdom Department of Energy and the United States Department of Energy (October 1986),
-
Palmer JR, Reeve JN. 1993. Methanogen Genes and the Molecular Biology of Methane Biosynthesis. In M. Sebald (Ed.), Genetics and Molecular Biology of Anaerobic Bacteria (pp. 13-35). Springer New York
[https://doi.org/10.1007/978-1-4615-7087-5_2]

-
Pandey A, Mai VT, Vu DQ, Bui TPL, Mai TLA, Jensen LS, de Neergaard A. 2014. Organic matter and water management strategies to reduce methane and nitrous oxide emissions from rice paddies in Vietnam. Agriculture, Ecosystems & Environment, 196, 137-146.
[https://doi.org/10.1016/j.agee.2014.06.010]

-
Peng J, Lü Z, Rui J, Lu Y. 2008. Dynamics of the Methanogenic Archaeal Community during Plant Residue Decomposition in an Anoxic Rice Field Soil. Applied and Environmental Microbiology, 74(9), 2894-2901.
[https://doi.org/10.1128/AEM.00070-08]

-
Pramanik P, Kim PJ. 2017. Contrasting effects of EDTA applications on the fluxes of methane and nitrous oxide emissions from straw-treated rice paddy soils. Journal of the Science of Food and Agriculture, 97(1), 278-283.
[https://doi.org/10.1002/jsfa.7727]

- Rajkishore S, Vignesh N, Doraisamy P, Maheswari M. 2015. Methane emission from rice ecosystems: 100 years of research.
- RDA (Rural development administration). 2005. Development of agricultural practices to mitigate greenhouse gases from agricultural sector. RDA.
- RDA (Rural development administration). 2012. Development of emission factors and assessment of emisison for methane at cropland in Korea. RDA.
- RDA (Rural development administration). 2013. Development of GHGs mitigation technology and their on-site assessment in paddy fields. RDA.
- RDA (Rural development administration). 2017. A study on greenhouse gas emission and applicative estimation under the IPCC Tier 3 level. RDA.
- RDA (Rural development administration). 2019. Development of methane scaling factor with the time of rice straw application and nitrous oxide emission factor with the types of animal manure for 2006 IPCC guideline. RDA.
- RDA (Rural development administration). 2020. An Experimental Study for reducing GHGs to Counteract New Climate Change Measures in crop fields. RDA.
-
Regina K, Pihlatie M, Esala M, Alakukku L. 2007. Methane fluxes on boreal arable soils. Agriculture, Ecosystems & Environment, 119(3), 346-352.
[https://doi.org/10.1016/j.agee.2006.08.002]

-
Sass RL, Fisher FM, Harcombe PA, Turner FT. 1990. Methane production and emission in a Texas rice field. Global Biogeochemical Cycles, 4(1), 47-68.
[https://doi.org/10.1029/GB004i001p00047]

-
Sass RL, Fisher FM, Lewis ST, Jund MF, Turner FT. 1994. Methane emissions from rice fields: Effect of soil properties. Global Biogeochemical Cycles, 8(2), 135-140.
[https://doi.org/10.1029/94GB00588]

- Saunois M, Stavert AR, Poulter B, Bousquet P, Canadell JG, Jackson RB, Raymond PA, Dlugokencky EJ, Houweling S,Patra PK. 2020. The global methane budget 2000–2017. Earth System Science Data, 12(3), 1561-1623.
-
Schütz H, Holzapfel-Pschorn A, Conrad R, Rennenberg H,Seiler W. 1989. A 3-year continuous record on the influence of daytime, season, and fertilizer treatment on methane emission rates from an Italian rice paddy. Journal of Geophysical Research: Atmospheres, 94 (D13), 16405-16416.
[https://doi.org/10.1029/JD094iD13p16405]

-
Sebacher DI, Harriess RC, Bartlett KB. 1983. Methane flux across the air-water interface: air velocity effects. Tellus B, 35B(2), 103-109.
[https://doi.org/10.1111/j.1600-0889.1983.tb00014.x]

-
Seiler W, Holzapfel-Pschorn A, Conrad R, Scharffe D. 1983. Methane emission from rice paddies. Journal of Atmospheric Chemistry, 1(3), 241-268.
[https://doi.org/10.1007/BF00058731]

-
Sethunathan N, Kumaraswamy S, Rath AK, Ramakrishnan B, Satpathy SN, Adhya TK, Rao VR. 2000. Methane Production, Oxidation, and Emission from Indian Rice Soils. Nutrient Cycling in Agroecosystems, 58(1), 377-388.
[https://doi.org/10.1023/A:1009891913511]

-
Setyanto P, Makarim AK, Fagi AM, Wassmann R, Buendia LV. 2000. Crop Management Affecting Methane Emissions from Irrigated and Rainfed Rice in Central Java (Indonesia). Nutrient Cycling in Agroecosystems, 58(1), 85-93.
[https://doi.org/10.1023/A:1009834300790]

- Setyanto P, Rosenani A, Boer R, Fauziah C, Khanif M. 2004. The effect of rice cultivars on methane emission from irrigated rice field.
- Singh S, Kashyap AK, Singh JS. 1998. Methane flux in relation to growth and phenology of a high yielding rice variety as affected by fertilization. Plant and Soil, 201(1), 157-164.
- Sinha SK. 1995. Global methane emission from rice paddies: excellent methodology but poor extrapolation. Current Science, Medium: X; Size: pp. 643-646.
-
Strack M, Waddington JM. 2008. Spatiotemporal variability in peatland subsurface methane dynamics. Journal of Geophysical Research: Biogeosciences, 113(G2).
[https://doi.org/10.1029/2007JG000472]

-
Suryavanshi P, Singh YV, Prasanna R, Bhatia A, Shivay YS. 2013. Pattern of methane emission and water productivity under different methods of rice crop establishment. Paddy and Water Environment, 11(1), 321-329.
[https://doi.org/10.1007/s10333-012-0323-5]

-
Tokida T, Fumoto T, Cheng W, Matsunami T, Adachi M, Katayanagi N, Matsushima M, Okawara Y, Nakamura H, Okada M, Sameshima R, Hasegawa T. 2010. Effects of free-air CO2 enrichment (FACE) and soil warming on CH4 emission from a rice paddy field: impact assessment and stoichiometric evaluation. Biogeosciences, 7(9), 2639-2653.
[https://doi.org/10.5194/bg-7-2639-2010]

-
Tokida T, Miyazaki T, Mizoguchi M. 2005. Ebullition of methane from peat with falling atmospheric pressure. Geophysical Research Letters, 32(13).
[https://doi.org/10.1029/2005GL022949]

-
Waghmode TR, Haque MM, Kim SY, Kim PJ. 2015. Effective Suppression of Methane Emission by 2-Bromoethanesulfonate during Rice Cultivation. PLOS ONE, 10(11), e0142569.
[https://doi.org/10.1371/journal.pone.0142569]

-
Wang B, Neue HU, Samonte HP. 1997. Effect of cultivar difference (‘IR72’, ‘IR65598’ and ‘Dular’) on methane emission. Agriculture, Ecosystems & Environment, 62(1), 31-40.
[https://doi.org/10.1016/S0167-8809(96)01115-2]

-
Wang ZP, DeLaune RD, Patrick Jr. WH, Masscheleyn PH. 1993. Soil Redox and pH Effects on Methane Production in a Flooded Rice Soil. Soil Science Society of America Journal, 57(2), 382-385.
[https://doi.org/10.2136/sssaj1993.03615995005700020016x]

-
Wassmann R, Martius C. 1997. Methane Emissions from the Amazon Floodplain. In W. J. Junk (Ed.), The Central Amazon Floodplain: Ecology of a Pulsing System (pp. 137-143). Springer Berlin Heidelberg
[https://doi.org/10.1007/978-3-662-03416-3_7]

-
Wassmann R, Neue HU, Bueno C, Lantin RS, Alberto MCR, Buendia LV, Bronson K, Papen H, Rennenberg H. 1998. Methane production capacities of different rice soils derived from inherent and exogenous substrates. Plant and Soil, 203(2), 227-237.
[https://doi.org/10.1023/A:1004357411814]

-
Watanabe A, Kimura M, Kasuya M, Kotake M, Katoh T. 1994. Methane in groundwater used for Japanese agriculture: Its relationship to other physico-chemical properties and possible tropospheric source strength. Geophysical Research Letters, 21(1), 41-44.
[https://doi.org/10.1029/93GL03325]

- WMO (World Meteorological Organization). 2020. WMO Greenhouse Gas Bulletin (GHG Bulletin) - No.16: The State of Greenhouse Gases in the Atmosphere Based on Global Observations through 2019
-
Yagi K, Minami K. 1990. Effect of organic matter application on methane emission from some Japanese paddy fields. Soil Science and Plant Nutrition, 36(4), 599-610.
[https://doi.org/10.1080/00380768.1990.10416797]

-
Yagi K, Minami K, Ogawa Y. 1998. Effects of water percolation on methane emission from rice paddies: a lysimeter experiment. Plant and Soil, 198(2), 193-200.
[https://doi.org/10.1023/A:1004379914540]

-
Yagi K, Tsuruta H, Minami K. 1997. Possible options for mitigating methane emission from rice cultivation. Nutrient Cycling in Agroecosystems, 49(1), 213-220.
[https://doi.org/10.1023/A:1009743909716]

-
Yang B, Xiong Z, Wang J, Xu X, Huang Q, Shen Q. 2015. Mitigating net global warming potential and greenhouse gas intensities by substituting chemical nitrogen fertilizers with organic fertilization strategies in rice–wheat annual rotation systems in China: A 3-year field experiment. Ecological Engineering, 81, 289-297.
[https://doi.org/10.1016/j.ecoleng.2015.04.071]

-
Yang J, Liu G, Ma J, Zhang G-B, Xu H. 2014. Effects of Urea and Controlled Release Urea Fertilizers on Methane Emission from Paddy Fields: A Multi-Year Field Study. Pedosphere, 24(5), 662-673.
[https://doi.org/10.1016/S1002-0160(14)60052-7]

-
Yang S-S, Chang H-L. 1998. Effect of environmental conditions on methane production and emission from paddy soil. Agriculture, Ecosystems & Environment, 69(1), 69-80.
[https://doi.org/10.1016/S0167-8809(98)00098-X]

-
Zhang A, Bian R, Pan G, Cui L, Hussain Q, Li L, Zheng J, Zheng J, Zhang X, Han X. 2012. Effects of biochar amendment on soil quality, crop yield and greenhouse gas emission in a Chinese rice paddy: a field study of 2 consecutive rice growing cycles. Field Crops Research, 127, 153-160.
[https://doi.org/10.1016/j.fcr.2011.11.020]

-
Zhang A, Cui L, Pan G, Li L, Hussain Q, Zhang X, Zheng J, Crowley D. 2010. Effect of biochar amendment on yield and methane and nitrous oxide emissions from a rice paddy from Tai Lake plain, China. Agriculture, Ecosystems & Environment, 139(4), 469-475.
[https://doi.org/10.1016/j.agee.2010.09.003]